
外泌體(exosomes)是由細胞內多泡體與細胞膜融合后,釋放到細胞外基質中的一種直徑約 30-120nm 的膜性囊泡。幾乎所有種類的細胞都能分泌外泌體,并存在于人體各種體液之中,包括血液、尿液、唾液、乳汁、腦脊髓液等。外泌體含有細胞特異的蛋白、脂質和核酸,能作為信號分子傳遞給其他細胞從而改變其他細胞的功能,參與免疫反應、抗原遞呈、腫瘤轉移、心腦血管系統、神經系統等生理和病理過程 。
外泌體可運載不同種類的核酸,如 DNA、mRNA 和 miRNA,rRNA,snoRNA 等,其中 miRNA 受到最多的關注,由于它在基因表達調控上有著重要作用。miRNA 是一類 17-24nt 長的小的非編碼 RNAs,是一類重要的 sRNA(small RNA,sRNA)。miRNA 通過與 mRNA 的 3’ UTR 或者開放閱讀框 ORF 區域結合,能介導基因的轉錄后沉默,與細胞增殖分化、遷移、疾病發生和疾病進展都有關系。外泌體的脂質雙層膜結構,能很好的保護其包被的 miRNA,使其可作為疾病診斷和預后的生物標志物[2],影響腫瘤生長、增殖和轉移。
外泌體smallRNA 測序可以得到不同組織、不同發育階段、不同疾病狀態下 sRNA 的表達情況,其中 miRNA、siRNA 以及 piRNA 是研究的熱點,也是項目分析的重點。外泌體smallRNA 測序可以找到不同樣本間差異表達的miRNA,也可以鑒定新的miRNA。通過生信分析得到其靶位點所在基因的 GO 功能注釋以及KEGG pathway 注釋,最終可以得到外泌體 small RNA 在生物體中參與的生命活動的一個清晰的生物信息圖譜。
數據量:10M clean reads/樣
檢測范圍廣:既能鑒定已知小RNA,又能發現新的小RNA。
(13)已知miRNA的堿基編輯分析;
(3)mir2disease注釋.
晚期卵巢癌細胞通常會發生大網膜脂肪組織處的轉移,但是網膜基質細胞來源的分子對卵巢癌生長的影響還未見太多報道。本文通過二代測序技術發現腫瘤相關的脂肪細胞和成纖維細胞中miR21的表達量明顯高于卵巢癌細胞。通過功能研究發現,腫瘤相關的脂肪細胞和成纖維細胞的miR21可以轉移到卵巢癌細胞中,從而抑制卵巢癌細胞凋亡并通過結合一個新發現的靶mRNA—APAF1賦予其化療抗性。這些數據表明,轉移性卵巢癌細胞的惡性表型可通過從相鄰網膜基質細胞來源的外泌體遞送miR21來獲得,抑制基質細胞來源的miR21可能是治療轉移性或復發性卵巢癌的一個新策略。
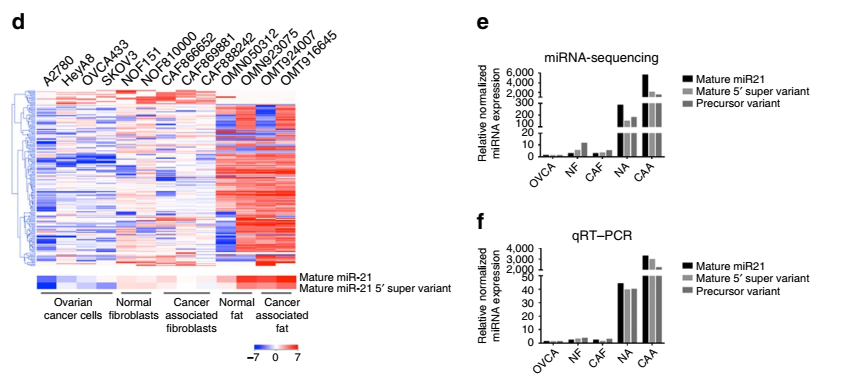
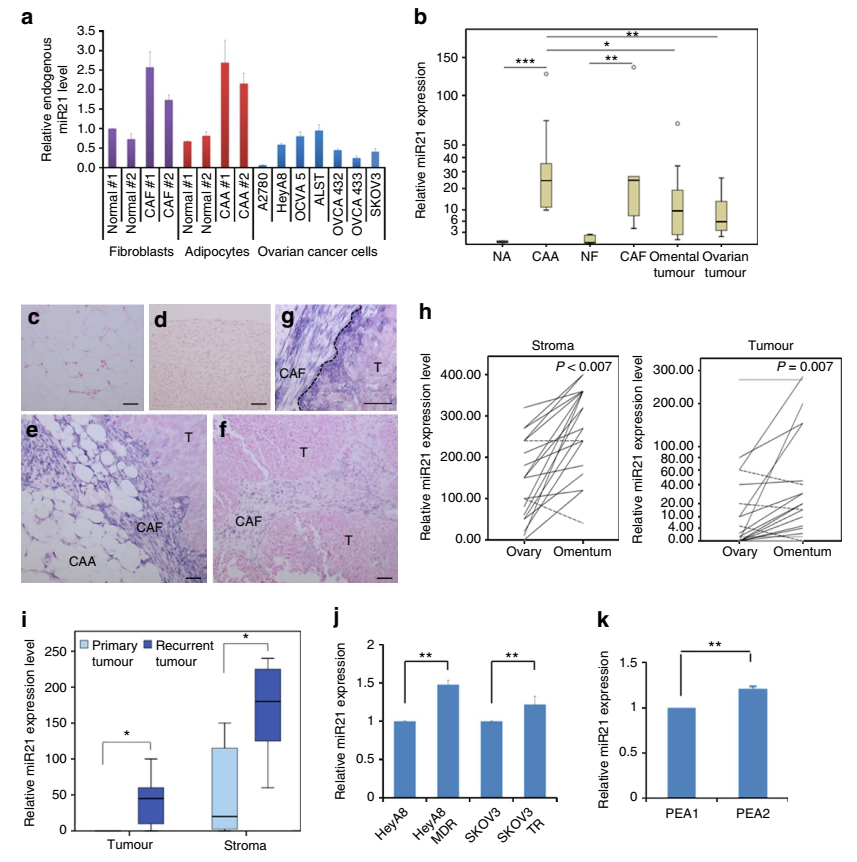
圖2 卵巢腫瘤組織和腫瘤細胞系中miR21的表達差異情況
案例(2)外泌體miRNA可用于非小細胞肺癌的早期診斷
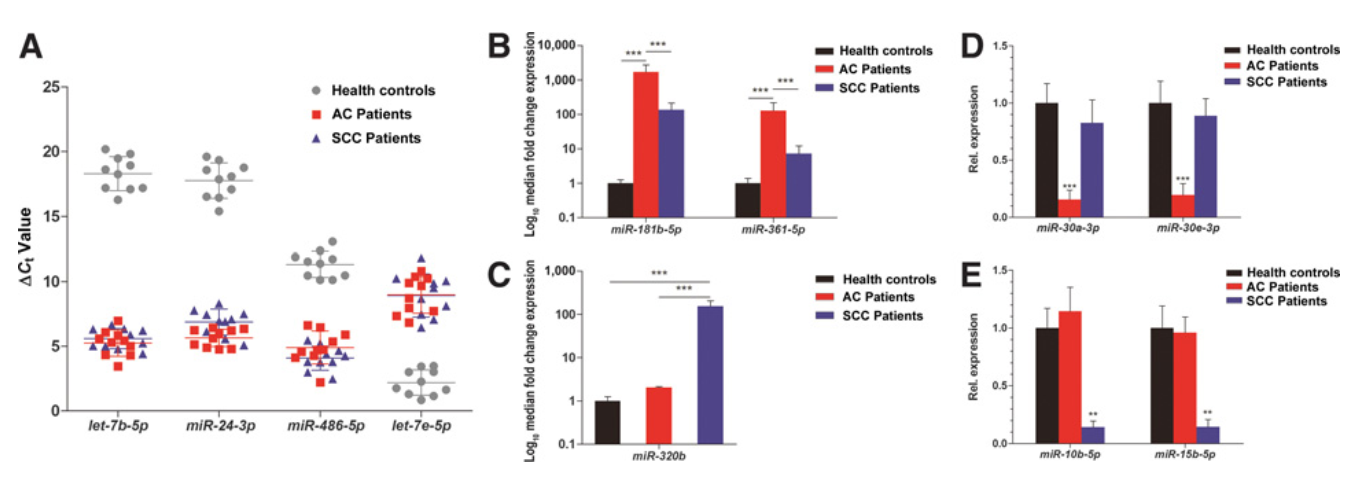
該研究從早期非小細胞肺癌(NSCLC)患者的血漿中分離腫瘤來源的外泌體。利用miRNA-seq對46個I期NSCLC患者和42個健康個體的外泌體miRNA進行分析,以鑒定和驗證腺癌(AC)和鱗狀細胞癌(SCC)的特異性miRNA。與健康個體相比,AC和SCC患者分別有11個和6個miRNA表達水平顯著增高,13個和8個miRNA表達水平顯著降低。不同的腺癌和鱗癌特異性的外泌體miRNA進一步被驗證。與以前研究報道一致,miRNA-seq數據證實了可用于診斷NSCLC和其他癌癥的潛在miRNA,如let-7、miR-21、miR-24和miR-486。結果表明,miR-181-5p、miR-30a-3p、miR-30e-3p和miR-361-5p為AC特異性的,miR-10b-5p、miR-15b-5p和miR-320b為SCC特異性的。采用AUC值為0.899、0.936和0.911,分別檢測NSCLC、AC和SCC,評估三種組合miRNA組的診斷準確度。這些miRNA在用于早期NSCLC診斷并用于高度敏感的非侵入性生物標志物是非常有希望的。
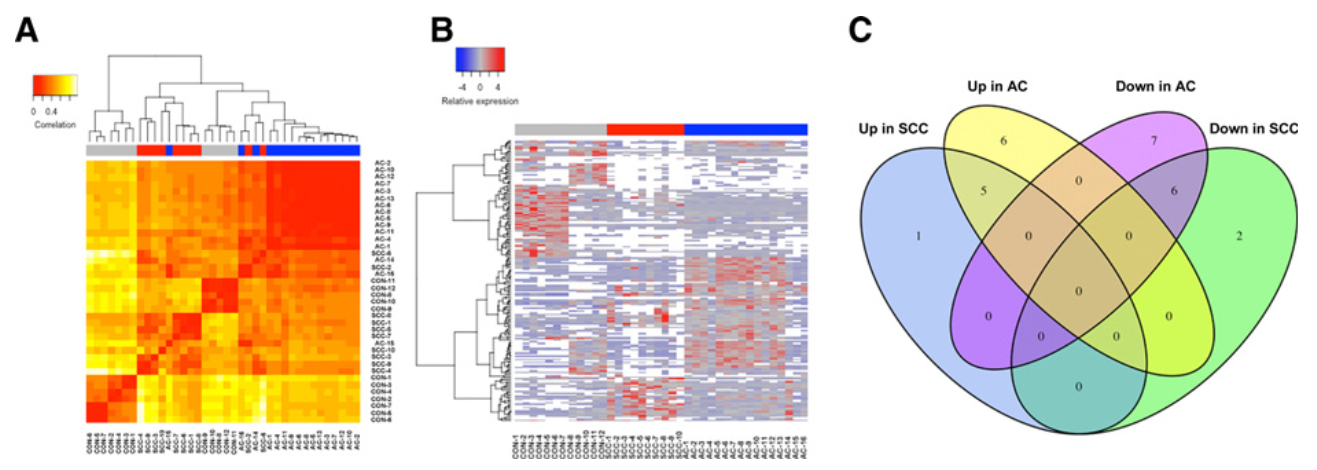
圖1 鑒定和定量健康個體、AC患者和SCC患者腫瘤來源的外泌體
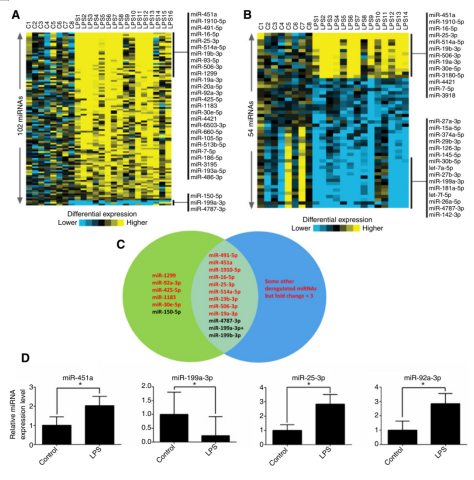
LPS患者樣本中PBV和PB的miRNA表達情況
[1] Au Yeung et al. Exosomal transfer of stroma-derived miR21 confers paclitaxel resistance in ovarian cancer cells through targeting APAF1. Nature Communications, 2016.
[2] Jin et al. Evaluation of tumor-derived exosomal miRNA as potential diagnostic biomarkers for early stage non-small-cell lung cancer using next-generation sequencing. Clinical Cancer Research, 2017.
[3] Casadei et al. Exosome-derived miR-25-3p and miR-92a-3p stimulate liposarcoma progression.Cancer Research, 2017.